こんにちは。
いつもお世話になっております。
暑い日が続いております。
寒がりな私にとっては暑いほうが良いわけですが、それでも暑すぎるともともと少ない意欲がさらにそがれてしまうわけで。
さて株の話です。
今日はこれまで治療法がなかった脳梗塞とか脳出血といった脳卒中に劇的に効くかも!っていう夢のお薬を開発しているサンバイオを分かりやすく紹介するぞ!
再生細胞薬「SB623」とは!?

これまで一度傷ついてしまった中枢神経は他の臓器のように再生しないと言われてきました。
事故なんかでまず脳とか脊髄に損傷がないか!と検査をされるのはこのためですね。
ところがバイオベンチャーのサンバイオが開発している再生細胞薬「SB623」は健康な人の骨髄から採取した間葉系幹細胞を加工・培養したもので、これを損傷部分に投与することで神経の再生を促進し、脳卒中により引き起こされた運動障害などを改善する効果が期待されているのです。
「SB623」はアメリカで18名の脳梗塞患者を対象にした小規模な初期の臨床試験(フェーズⅠ/Ⅱa臨床試験)を終えています。
18名という少人数の試験ではありますが、その結果は大変夢のあるものでした。
ほぼ全員の運動機能が有意に改善し、目立った副作用もなし。
人によっては動かなかった患者の腕が肩まで上がるようになったり、歩けなかった患者が自ら歩行できるようになったり……。
これまでリハビリをしても改善の見られなかった運動機能が、「SB623」を投与することで劇的に改善したのです。
まさに夢の薬といってよいでしょう!!
なぜSB623は脳を再生するのか?
これが実はよくわかっていません……。
会社が立てている仮説としては下記のようなもの↓
・SB623は体内に残らずに、時間をかけて死滅していく
・SB623は死滅するときにFGF2という物質を大量に放出する
・このFGF2が神経細胞の成長再生を促しているのではないか?
というものです。
これはあくまでも会社側の仮説であり、詳しいメカニズムは明らかになっていません。
ただ、このFGF2が神経細胞を増殖させる事実はおそらく間違いないでしょう。
なぜならFGF2の濃度が上がると、細胞の増殖を示すBRDU Incorporationの数値もグイーンと上がっていくことが判ったからです。
さらに注目すべきは、このFGF2が再生するのは脳細胞だけではありません。
損傷した血管の再生も担っているのです。
これはどういうことかというと、脳細胞の再生効果が持続するということです。
血管が損傷したままなら、再び脳細胞は死滅していきます。
ところが、血管も再生されればその効果は持続するわけ。
今のところこうした仕組みで、SB623は中枢神経系再生を促すと考えられています。
脳卒中の治療法がないので「SB623」が上市すれば独占状態に!
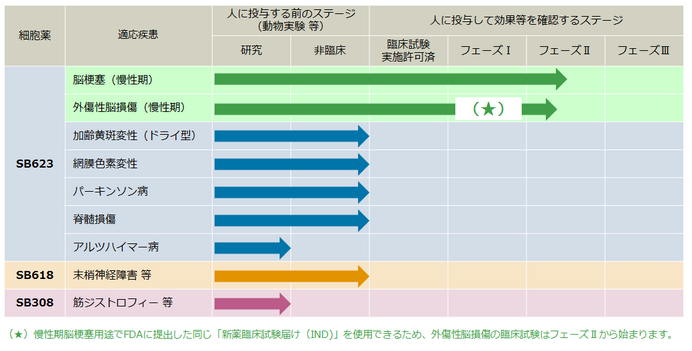
現在、「SB623」は次の臨床試験に移っています。
慢性脳梗塞用途はアメリカで開発中。外傷性脳損傷用途は日本とアメリカで開発中です。
出典:サンバイオホームページ
なお、慢性脳梗塞のアメリカ・カナダの開発販売権は共同開発・販売権を2010年に大日本住友製薬に導出済み。今後の開発進展に応じて、サンバイオにはマイルストーン収入と上市後のロイヤリティ収入が支払われます。
現在、この慢性脳梗塞用途ではアメリカで開発しており、患者156人を対象に、本当に有効性があるのか!ちゃんと安全なのか!の治験の真っ最中。
さらに外傷性脳損傷を対象とした開発は、アメリカと日本の2ヶ国での進められています。国際共同治験フェイズ2は見事に成功。
日本では再生医療品の早期承認制度が創設されており、これを活用することで2019年にも承認申請が行われる見込みとなっています。
【2018年11月1日追記事項】
外傷性脳損傷を対象にした第2相試験の結果が出ました。今回の治験の主要評価項目であるFugl-Meyer Motor Scale(患者の運動機能やバランス、感覚などを総合的に評価するテスト)で、プラセボが2.4点のところSB623投与群では8.7点と有意な改善が見られました。治験成功です!
これに続き、慢性脳梗塞用途でもSB623の効果が実証されたら……。
今まで治療法がなかった障害の解決方法として「SB623」は大注目されるでしょうし、独占状態となることは容易に想像できます。
なお将来的には目のアルツハイマーと言われる加齢黄斑変性への用途拡大なども視野にれており、うまくいけばとんでもないことになるでしょう。
ただ逆に言えば「SB623」の臨床試験が思うような結果が出なかったら。
大黒柱が発泡スチロールだったって話なので、会社のビジネスモデル自体がぶっ壊れちゃいます。
うーん、ザ・バイオ株!
【追記】外傷性脳損傷の治験が成功したことにより、SB623の効果の信憑性は飛躍的に高まりました。慢性脳梗塞用途での治験結果にも注目が集まります。
スポンサーリンク
[ad#co-1]
流れはサンバイオにきてるぞ!!
日本は再生医療にめっちゃくちゃ力を入れています。
早期承認制度はまさにそれ。
この制度は簡単に言うと、なんとこれまでフェイズ3までクリアしないといけなかった臨床試験がフェイズ2終了時点で効果が実証されたら販売してもええで!っていう制度なのです。
また「SB623」は複数の国又は地域で同時に実施する治験、いわゆる「国際共同治験」の形で日本ではいきなりフェイズ2(安全性と有効性を検証する臨床試験)から実施します。
つまり一撃の治験で上市できちゃうかもっていうお薬の世界では圧倒的なスピード感ある展開も!
【追記】外傷性脳損傷用途での治験が成功したため、会社では2019年の承認申請を予定しています。
大きな有効性が示されれば、上市後は加速度的な急成長を遂げていくと思われます。
特にアメリカの脳卒中患者は660万人。
そしてこれからも急速に増加していくことが見込まれています。
バイオ銘柄に精通しているいちよしの山崎さんもピーク時売上額が1兆1000億に上り、サンバイオにもロイヤルティやマイルストーンで計3000億程度入ってくるのではと試算しています。
現在でも時価総額的にはバイオでも高いほうですが、最初の臨床試験の結果を見るとまだまだ割安感を感じるバイオ株と言えるでしょう。
あえて問題を上げるとすれば、慢性脳梗塞用途の臨床試験に思わぬ時間がかかっているということ。
というのも、通常の飲み薬の治験と異なり、投与する医療機関と観察する医療機関は一緒なんですが、SB623の場合はプラセボの影響を排除するために、これら二つの医療機関が別々にされています。
この複雑性から患者の組み入れにも時間がかかっており、治験終了の時期が非常に不透明。
おそらく会社側としても見定めきれていないのでは、と思います。
ただ、治験を担当している大日本住友製薬も「今後状況が急激に改善する可能性もある」としており、ぜひともそうなることを期待するばかりです。
まとめ
実に夢のある会社ですが、実際にサンバイオは大手製薬企業からも高く評価されています。
北米では大日本住友製薬と提携。
さらに他の多くの研究機関と連携しています。
日本でも開発・販売権を帝人にライセンスアウト。
【追記】2018年2月、帝人とのライセンスアウト契約は解消されました。サンバイオと帝人との製品開発方針に食い違いが出てきた模様です。
早期にライセンスアウトしてコストを抑えながらも、ロイヤルティは10%代後半と想定されており、他のバイオベンチャーでよくある数%とかと比べてめちゃくちゃ高い!
まさに「SB623」の評価が高いことの証左と言えるでしょう。
とはいえ蓋を開けてみるまで分からないのが臨床試験。
もしも慢性脳梗塞の治験で失敗しちゃったらアキュセラショックの再来となるであろうことは十分留意しておく必要があると思います。
ただより難易度が高いと言われていた外傷性脳損傷の臨床試験の結果を見る限り、成功確率は高いと思うのですが……。
時価総額はマザーズのトップクラスである4,000億を近辺まできました。SB623の期待値は高いとはいえ、ハイリスクなのは間違いなし。余剰資金での投資をおススメします。
頑張れ、サンバイオ!
【追記】国際共同治験の進捗ですが、患者の組み入れに時間がかかっているようです。
[kanren postid=”2266″]
【さらに追記】一方、国内のTBI用途の治験については順調に進捗か?⇒っていうか、成功しました。
[kanren postid=”3798″]










私は脳内出血になってから7ヶ月です、毎日サンバイオ関連の記事を見ています。臨床試験募集など情報があったら教えて下さい。お願いします。