いつもお世話になっております!
3Dマトリックスの2018年4月期第2四半期決算説明会資料が公表されました。
さっそく感想を書いていくぞ!
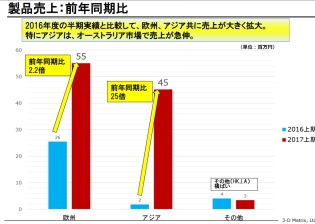
今期上期の売上は前年同期比で大幅増!
出典:平成30年4月期第2四半期決算説明会資料
出たー!
得意の矢印だ。
アジアの急角度。
なんと前年同期比25倍だぞ。
「去年が売れなさすぎだっただけじゃん……」
ってツッコむことすら疲れてきたね。
そして2Qの売上鈍化の言い訳としては下記の通り。
出典:平成30年4月期第2四半期決算説明会資料
3Dの代理店って買収されまくってんな。笑
英国の代理店って大手のDiagmedじゃないよね?
それにしても、ちょっと言い訳としては弱いんじゃないか。
「一部」代理店の離脱だけで、こんなに計画未達になるかー?
それとスペイン!
そりゃないだろ。
半年前の決算説明会では、岡田社長「イタリア・スペインについては他国とは全く違う状況。代理店も準備もしっかりしてるし、モチベーションも高い。だけど入札が始まらないから売りたくても売れない状況なんだ!」って言ってたじゃん。
やっと入札が始まったのに、なんで代理店やる気なくなっちゃってんのよ。
はぁ。
後出血予防材の治験成功! CEマーク再申請!
出典:平成30年4月期第2四半期決算説明会資料
マジっすか。
目を疑ったぞ。
3Dマトリックスの止血材purastatの適用拡大である後出血予防材の追加治験が成功してました。
さらに再申請済み。
これはポジティブサプライズ。
つーかなんで発表しないんだよ。
どうでも良い特許取得のIRは出すのに、これは出さないって意味が分からんな。
本当に謎な会社だよマトちゃんは!
今回の治験では76症例に対してpurastatが投与され、ヒストリカルコントロール群(過去の同様の症例)202例と比較して50%以上後出血率を抑制できたとのこと。
簡便性もあり、安全性に問題なかったとのことですので、できれば今期中、遅くても来期初めにはCEマークが取れるものと期待しています。
ただ、スライド2ページ目に90症例のランダム化比較試験を実施って書いているのに、なんで13ページ目の評価対象がヒストリカルコントロールなのか……。
よく分からん。
同時に実施した比較対処とは50%以上もの差はなかった(医者の腕が上がってきている)とかで、ヒストリカルコントロールとの差で再申請を出したということなのか……。
いずれにしても、後出血予防を目的として使用ができるようになれば、絶不調のpurastatの販売押し上げに繋がる……はず!
とりあえず良かったです!
やるじゃねーか、マトちゃん。
アンメットニーズってところが良いね。
いくら市場規模が大きくても、中々競合製品からシェアを取っていくのは難しいってことがよく分かったんで、「空白領域」を攻めていく戦略には大賛成です。
次世代止血材の開発も順調に進展!
purastatよりも止血効果が高く、利益率も高いという次世代止血材。
こちらも順調なようで今期中には臨床試験に入れる見込み。
どうしたよ。
マトちゃんらしからぬ順調さじゃん
より大きなマーケットである他の領域で戦えるだけの強烈な止血効果を示してほしいもんだ。
急いでくれ!
癒着防止材の臨床デザインも決定!
これもポジティブサプライズ。
なんとFDAと承認に向けての臨床プロトコルが決まっちゃったよ。
それどころかもう動物実験が始まっちゃってるよ。
出典:平成30年4月期第2四半期決算説明会資料
耳鼻咽喉科領域を対象に、ヒトでの臨床試験がいらない510(K)での申請をするそう。
専用製品ではなく、こちらもpurastatを使うようです。
そしてヒトでの臨床データも揃っている耳鼻咽喉科領域に絞って、まずは承認を取るという戦略を採用したようですね。
資金も余裕がないし、妥当性があると思います。
動物実験の結果だけで申請が可能なので時間もかからないかと。
ウサギさん相手に、MeroGelって製品と比較して、どちらが癒着を軽減できるか対決になります。
MeroGelって調べてみるとヒアルロン酸などを原料とした創傷治癒や癒着防止のために使用される製品な模様。
論文なんかもさっと見てみたけど、既に洗脳から溶けたワタクシの客観的な視点から言ってもpurastat勝てると思うぜ!
なんせ60症例で癒着ゼロだもん。
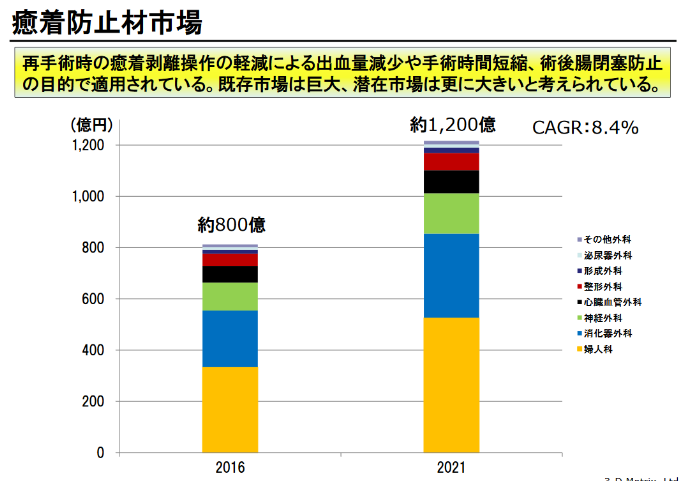
ただ、このグラフは出さない方が良いと思う。
出典:平成30年4月期第2四半期決算説明会資料
だってここに耳鼻咽喉科って入ってないじゃん。
その他のところに入ってるんだとしたら、市場規模って米粒レベル。
まるで今回の510(K)の承認がゲットできたら、いきなり800億市場にアプローチできるかのような出し方は誤解を生むと思うのであんまり好きじゃないです。
それでも繰り返しになりますが、耳鼻咽喉科分野における既存市場は米粒レベルで競合品がほとんどないからこそ、承認されれば潜在市場の開拓も進みやすいと思うので、まずは適用分野を絞った今回の戦略は大賛成。
ちょうど1年前の決算説明資料。
オーストラリアだけでの耳鼻咽喉科の止血材市場が20~40億と推定してた事実も忘れてないよ(推定の正確性については疑問だけど……)。
いずれにしても世界最大市場のアメリカでの展開……期待したいです。
あとは社長の説明動画で、他の領域でも承認を取っていくつもりがあるのかどうかとか、今後の戦略についても言及があればよいですね。
まとめ
・マトちゃんには珍しく順調! ……一番重要な止血材の販売以外は。
悪くなかったですね。
後出血予防材と癒着防止材は特に良かった。
社長の買い煽りはイマイチ信用できないところがありますが、「決定した事実」は否定しようがないので。
しかし「止血材が売れてない」のもまた事実。
今後の売買は判断が難しいところですが、TDM-812の結果がもう少しで出そうなので、それまではホールドしときます。
それでは年末か年明けに公開されるであろう、今回の資料に基づいた岡田社長の買い煽りプレゼンもお楽しみに!













おはようございます。
3Dマトリックス、やりましたね!後出血予防材再申請と、耳鼻咽喉科における癒着防止材510で-FDAと合意!
本当に久しぶりに素晴らしい内容でした~!
なんでIR出さないのか短信に書かないのかという、正直イラッとした気持ちもわきましたが、これも1つの戦略?かもしれないですし。
後出血予防材さえ成功したら、かなり景色が変わって見えると思います。(もしかしたら欧州提携も夢ではなくなるかもしれないし)
在庫大幅に増えたのも何となく点と点が繋がりました。
これで安心して(というのは言い過ぎ)ガッチリホールドします。
来月にはtdm812も出そうですね。こちらもうまくいく予感がします。
私も洗脳は完全に溶けたけど(笑)、もう少し3Dマトリックスの行く末を見守ろうと思いました。