いつもお世話になっております!
ぼくが先日まで全力で疑っていた3Dマトリックスさんの後出血予防材の承認。
それが本日、マトちゃんが日経産業新聞にヨーロッパの承認機関であるBSIグループから承認書のドラフト(下書き)を受領したとの掲載がなされました。
見たか、ぼくのこの逆神っぷりを!
後出血予防材承認へ

日経産業新聞によると、承認書のドラフト(下書き)っていうのは日本でいうところの薬事・食品衛生審議会の部会通過に当たるんだって。
日本の基準と同様とすると、部会さえ通過すればあとは形式的な手続きだけで、偉い人のハンコを待つばかりという認識です。
おめでとう3Dマトリックス。事実上の後出血予防材承認だ。
一応、この新聞記事が正しいのかIRに確認しておかないとな。
なんせぼくはHMTの「うつ病診断薬の近く治験開始」って新聞が出たときにコロッと騙されちゃった過去があるからね。
あのときは会社に確認したら、「あ、あれ間違いだからクレーム出しといたよ」って言われちゃったんだもん。
もうトラウマですよ。
ってことで、マトちゃんに電話をしました。
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/05/cropped-logo.jpg” name=”(僕)” type=”l line”]お忙しいところ恐れ入りますぅ。ワタクシ個人株主のものなんですが、本日の日経産業新聞の朝刊に、認証機関から後出血予防材の承認書のドラフトを受け取ったっていう記事が出てましたけど、これって事実なんでしょうか?[/voice]
この低姿勢っぷりが素晴らしいよね。IRさんには優しくしないと。キミたちすぐ怒鳴っちゃうんだもんなあ。
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/06/face14.gif” name=”(IRさん)” type=”r”]はい、それに関しては事実でございますが、まだ正式承認を得たというものではありません[/voice]
それはそうですね。書いてある通りです。ドラフトを受領したのが事実って分かっただけで安心だよ。多分、分かんないだろうなあと思いながらも、念のため追加で訊いてみました。
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/05/cropped-logo.jpg” name=”(僕)” type=”l line”]ドラフト受け取って、その後のプロセスで否決されることってあり得るんですか?[/voice]
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/06/face14.gif” name=”(IRさん)” type=”r”]……そこまでは私のほうでは分からないんですが[/voice]
ですよね。了解です。
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/05/cropped-logo.jpg” name=”(僕)” type=”l line”]分かりました。ありがとうございました。失礼いたしますぅ[/voice]
最後まで低姿勢を貫くぼく。3Dマトリックスの電話に出るIRさんは「窓口」的な感じなので、あまり深いところまで訊いても回答はありません。何年も株主を続けていると達観したよ。
いずれにしても、ドラフト受領が「事実」ってことが分かっただけで満足だ。承認はほぼ確と言って良いでしょう。
[ad#co-9]
今後の売上に注目!

日経産業新聞には、今回の株価暴騰劇の一翼を担っていると思われる岡田社長のありがたいお言葉が書いてあります。
岡田社長は「内視鏡の粘膜切除術(EMR)では、予防目的で患者全員にピュアスタットを塗りたいという医師が全体の半分くらいいる」と述べる。
コレコレコレ!
読んだときにぼくはニヤけちゃったもんなあ。
相変わらず買い煽るねえ。
ちなみにこのありがたい言葉の中には、本来は根拠となる(○○○によると)が入るわけですよ。
ですよね?
「(○○○によると)内視鏡の粘膜切除術(EMR)では、予防目的で患者全員にピュアスタットを塗りたいという医師が全体の半分くらいいる」って、まるまるまるが岡田社長の心の中にはあるわけ。
○○○をどう読み解くかがすんごい大事になってきます。
例えば、
- (おフランスの医者が東京に来てさ、5人くらいで六本木で飲んでたときに訊いたら、3人が患者全員に塗るって言ってたことによると……)内視鏡の粘膜切除術(EMR)では、略
なのか
- (purastatファンのポーツマス病院のバンダリちゃんに訊いたらさ、「岡ちゃん、だいたい半分の医者は塗るんじゃねえかな」って言われたことよると……)内視鏡の粘膜切除術(EMR)では、略
なのか
- (ヨーロッパのタウンページを見てさ、新井にふぁくしみりあんけーつを送ってもらったんだよ。後出血を予防できるゲルがあったら使うかって。その結果によると……)内視鏡の粘膜切除術(EMR)では、略
なのか。
〇〇〇によって、「半分」の信憑性って全然変わってくるからね。
まあ冗談ですが、ヨーロッパの医者の半分がpurastatを塗りたいって、それどこ情報なのよ?ってツッコミはあるでしょう。
ヨーロッパの内視鏡科医全員になんて訊けるわけないもん。
定量データなんてもちろんないし。
サラーっと新聞を読んだら「ヨーロッパの医者の半分」が使うっていう風に読めますが、これはちょっと盛り過ぎ。
少なくとも「purastatを既にガッツリ使っている医者の半分」くらいに思っておけば良いのではないでしょうか。
purastatのヘビーユーザーなら後出血予防にも使う割合も高くなると考えるのが自然です。
何を言いたいかというと、新聞の「医師の半分が使う」という発言だけで、過剰な売上見込みを立てることは危険ということ。
記事によると、
EMRの実施件数年間50万件×後出血適用割合60%×単価2.7万円/回=市場規模80億円でしょ。
この50%って40億でっせ。
40億×粗利率70%とすると28億円。
実現すれば楽勝で固定費回収して、はい黒字転換でーす。
黒字転換どころかこれはEMRだけの数字。プラス後出血予防材が適用される可能性がある大腸ポリープなどのポリペクトミーの件数も加われば何倍もの売上が見込めます。
でもねえ。なかなかこんなうまくいかないぜ。
なんせこれまで伝説の99%下方修正を皮切りに、その後もトンデモ中期経営計画を出し続けている3Dマトリックスさんだしね。
4年前の中期経営計画を見よ!
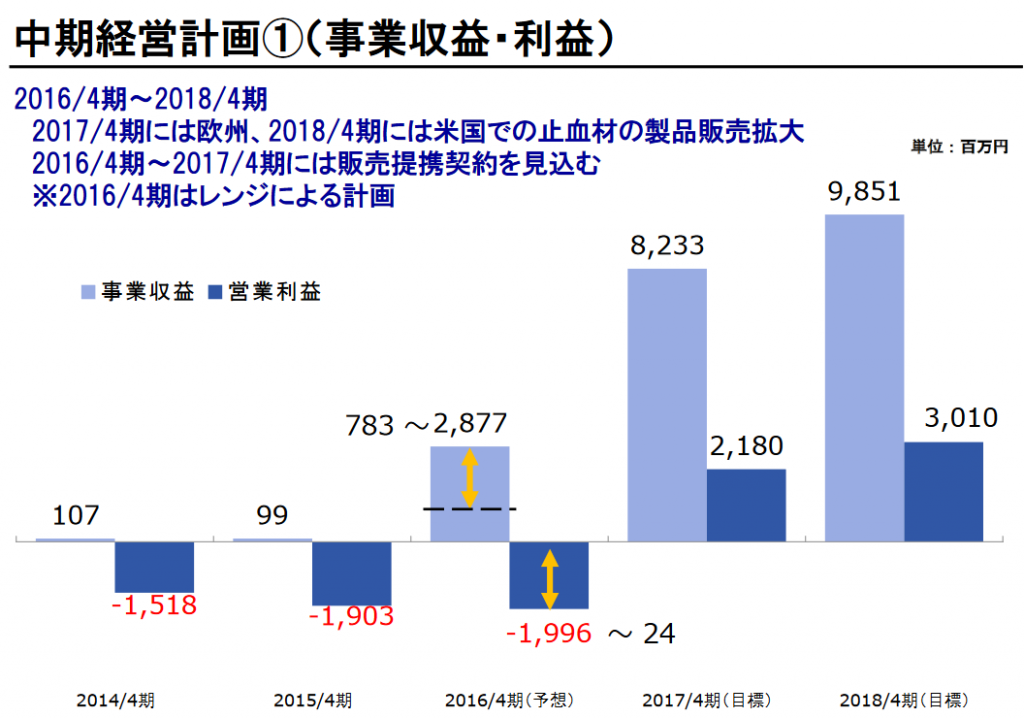
2018年4月期の売上目標に注目!
98億円。実際の2018年4月期の売上は2億3000万円でした。
すさまじい絵に描いた餅っぷり。
こんな会社の言うことを、そうやすやすと信じることはできないぞ。
結論⇒「医師の半分が予防目的で患者全員に使う」は疑問。
ただーし。
現在purastatが適応される内視鏡術での止血が起きるケースって5%くらいしかない。市場規模にするとわずか10億。
3Dマトリックスのヨーロッパでの前期売上は1億5,000万円で、この多くは内視鏡向けと思われます。
1.5億/10億なので、市場規模の15%くらいはカバーできてるんですね。これもまた現実。
これをベースに考えたほうが良さそうだ。
出血はしないけど、後出血が起こるかもしれないケースはこの8.5倍(会社発表)。
少なくとも既にpurastatをリピートしている医師の「半分」が後出血用としても使うとすれば、1.5億×8.5×0.5=6.3億円/年。
うん。テキトーすぎるけどそれなりに妥当な数字のような気がするぞ。
この辺りを最低線として、あとは積み増していってほしいな。
後出血予防材が確かにニーズのあるものなのか、承認後の売上(今期の第4四半期2月~4月)に注目です。
いやあホント頑張ってほしいぜ。
今回の発表を機に、過去の自分のブログも見返していましたが、当初3Dマトリックスは圧倒的に市場規模が大きい一般外科領域などでの販路拡大を狙っていたように思われます。
ただしそこは競合ひしめくレッドオーシャン。purastatは、競合品と比べて競争力が発揮できなかったと言わざるを得ません、
そこで最近は内視鏡というニッチながらも競争優位性を発揮できる領域で確実に市場を捕捉する戦略に切り替えてきました。
ぼくは昔からちゃんとこの戦略については評価してるんですよ。ほらこの通り。
[kanren postid=”2988″]
ね。
もう前回の記事は忘れてください。ぼくの得意技は手のひら返しだからね。
岡田社長、ほんと疑ってすいませんでした。ぼくは今、正座をしながらキーボードを叩いています。
これからも頑張ってください。ぼくに穏やかな老後を過ごさせてください。
[ad#co-9]
新聞パワーの持続性に注目!

それにしても新聞パワーすごすぎますね。
確実に3Dマトリックスなんて一ミリも知らない人たちもたくさん買ったことでしょう。
あの記事だけ見たらそりゃ魅力的だよなあ。
結果的に、良いか悪いかはおいといて、普通にIRするより株価を上げられた結果になったように思えます。ただし新聞パワーによる株価の向上は持続性がまるでないイメージ。
明日は普通にマイ転もありそう。
疑心暗鬼になる気持ちも分かってよ。
まあ良いや。どうせぼくはスーパー長期ぬか漬けホルダー。これでワラントの行使が進めば満足です。
むしろ捌ききっちゃって。
400円台に逆戻りしても、危惧していた非承認も避けられたわけだし万々歳だよ。
今後の期待する戦略について
後出血予防材が本当に売れるかどうか、過去の見込みの甘さからいうとまだまだ信用度が高いとは言えません。
ただし戦略としてはやはりこの方向性しかないと思うんですよね。
ニッチな競合がいない分野で攻めていくしかない。
というわけで、個人的には今後は同じく内視鏡手術で使われる粘膜隆起材に経営資源を投下しまくってほしい。
賛否あると思いますが、歯槽骨再建材なんてしばらく放っておいて良いよ。どうせ時間かかるんでしょ。
なんなら次世代止血材も止めて良い。創傷治癒材も置いとけ。
一から販路を作るのは時間が掛かりすぎる。お金もかかりすぎる。人もそんなにいないじゃん。
粘膜隆起材だ。とにかく粘膜隆起材。粘膜隆起材最優先。
[kanren postid=”3959″]
日本での治験再開を目指しているけど、ヨーロッパも早くしましょうよ。
粘膜隆起材なら既存の販路を利用するだけなので、効率的に売上拡大に繋げられる。
ヨーロッパで販路ができてきた「内視鏡分野で尖りまくり戦略」をぜひ採用してほしいと思います。
まとめ
・後出血予防材の承認取得がほぼ確
・新聞パワー強烈すぎ
・売上実績をだしてください
・次は粘膜隆起材だ
久しぶりに良いニュースが出ました。
マジで良かったよ……。
これでぼくが今期に期待している3大材料のひとつ「後出血予防材の承認」が実現しそうです。
あとはアメリカの癒着防止材の承認と、国内止血材(内視鏡領域)の治験成功ですね。
首を長くして待っています。










yukiyukiさん、おはようございます。
私は今日、会社を休んで南紀白浜へ一泊旅行のため、朝からyukiyukiさんのブログを読むことができました。
昨日のストップ高にビックリして、Yahoo掲示板を読んでも、もう一つ理解できなかったんですが、yukiyukiさんの記事を読んで確信が持てました。有難うございます。
先日の米国の癒着防止材申請に続いて、ホッ~と一安心しています。
うまくいけば、来期はPurastatが10億円ぐらい売れるかもしれませんね~(それでも、大手との契約一時金がなければ赤字…)
今日の株価はどうなるんでしょう? 白浜までのバス車中で、楽しみにスマホを見ることにいたします。