いつもお世話になっております!
暑い! 今日も暑すぎる! めまいがするほど暑すぎる!
一方、愛する3Dマトリックスさんの株価だけは寒すぎる。
あーあ。
最近のマトちゃんですが、大学や公的機関と共同で核酸医薬品開発を推し進めようとしていますね。
先日も広島大学と共同で行う、マイクロRNAと呼ばれる核酸を用いた「悪性胸膜中皮腫」を対象とした核酸医薬品開発プロジェクトが、日本医療研究開発機構(AMED)の「革新的医療技術創出拠点プロジェクト」に採択されたと発表しました。
中皮腫の核酸医薬品開発については決算説明会でも説明されていましたので、まぁ大きな材料でもなく。
発表翌日の株価は、予想通りの寄り天ぶりを発揮してくれました。
さすがだよなぁ。
ただよくよく調べてみると、わりと良い内容かもなぁと思ってきました。
ちょっとだけね。
今回は自分のためにもこの材料について整理してみます。
「革新的医療技術創出拠点プロジェクト」とは!
画期的な医薬品・医療機器を創出するため、基礎研究成果を一気通貫に実用化に繋げるための支援制度です。
日本版NIHと言われるAMEDさんが中心になっている事業ですね。
今回、3Dマトリックスさんの共同研究先となっている広島大学さんが採択を受けたのは、「革新的医療技術創出拠点プロジェクト」のシーズBと呼ばれる分野に該当します。
このプロジェクトの目的としては非臨床のPOC(お薬の期待した効果が発揮されそうだぞって裏付け)取得。
研究機関は最長3年間で毎年最大7,000万円の委託費が広島大学に入ります。
国内の助成事業の中では比較的規模は大きめ。
サンバイオがアメリカで20億の補助金を受けたのを見ると「しょぼ……」ってなっちゃいますが……。
シーズBは今回の応募数が87のところ採択数は28。
採択率は3割くらいとなっています。
というわけで、申請書を出せば通るってもんではなさそうです。
気になる研究テーマは!?
今回の共同プロジェクトの研究開発課題名は……
【がん幹細胞および抗癌剤耐性がん細胞に作用する革新的抗腫瘍核酸医薬品の開発】
となっています。
格好いいぞ。
研究開発代表者は広島大学の田原栄俊先生。
日本RNAⅰ 研究会の会長を務めるなど、国内のRNA関連の研究でトップを走る方なのだ。
……ただど文系人間のワタクシには、そもそもRNAがなんなのかよく分かっていない。
DNAとどう違うんだよ。
調べてみると、
ワタクシたちが先代から脈々と受け継いできた遺伝情報(ワタクシが後進に受け継げられるかは分からない)を保存する役割を担っていて、ヒトの細胞の核に存在しているのがDNA。
一方、RNAは、DNAから
1.遺伝情報を写しとったり(mRNA)
2.バラバラな状態のアミノ酸をリボソームというたんぱく質の合成工場みたいな場所に運んだり(tRNA)
3.リボソーム内でアミノ酸を遺伝情報に基づいて配列し、たんぱく質を合成したり(rRNA)
っていう役割を担っています。
アリさんもビックリの働きもんだぜ。
で、マイクロRNAはなんだっていうと……もうなんか頭がわちゃくちゃになってきましたが、なんのせ「遺伝子発現の調節作業」をしているらしい。
で、調節がうまくいかないと病気になったりがんになったりするわけです。
*もしも間違ってたらこの辺、詳しい人教えてください……。
今回の研究は、マイクロRNAを用いてがんの親玉である「がん幹細胞」や抗がん剤が効かなくなった「耐性がん細胞」の両方に効果を発揮する核酸医薬を作っちゃうぞー!という夢のあるプロジェクトなんです!
なんでマイクロRNA核酸医薬品は有効な癌治療薬になり得るのか!?
そもそもがん細胞が恐ろしい理由。
以前、オンコリスバイオの紹介をしたときにも書きましたが、がん細胞には寿命がないから。
[kanren postid=”2865″]
がん細胞は老化せずに細胞分裂が無限に繰り返されることで、死んじゃうどころかどんどん増殖していっちゃうのです。
ではがん細胞を老化へと誘導できればいいのでは……?
田原先生が着目したのが、そうマイクロRNA。
こちらのサイトで田原先生のインタビューが詳しく掲載されています。
【参考:がん研究分野の特性等を踏まえた支援活動(リンク切れ)】
インタビュー記事を見ていくと、田原先生が取り組んでいる「老化誘導型マイクロRNA」を用いた核酸医薬品の作用機序がよく分かります。
まず田原先生は、「様々なたんぱく質や細胞の合成を制御しているマイクロRNAは、きっと細胞の老化にも関わっているに違いない!」と思ったんだそう。
そしてヒトの若い細胞と老化した細胞を比較し、老化した細胞に特異的に発現するマイクロRNA……つまりがん細胞を老化に導くマイクロRNAを探し当てました。
それが「マイクロRNA22」です。
実際に乳がんの細胞や子宮頸がんの細胞を調べると、マイクロRNA22が顕著に少なかったとのこと。
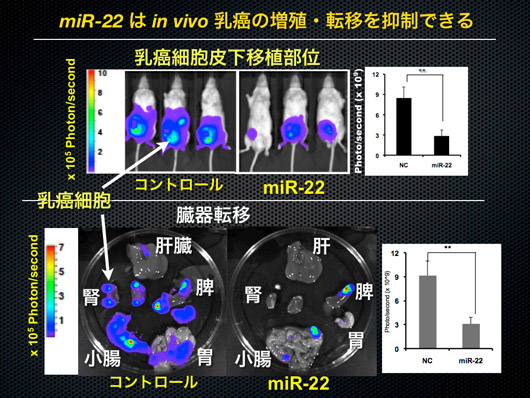
高転移のがん細胞をネズミさんに移植をして、マイクロRNA22を投与した結果は下記になります。
【出典:がん研究分野の特性等を踏まえた支援活動】
顕著にがん細胞が縮小しているほか、転移も抑制されていることがよく分かります。
今回の中皮腫に対してはマイクロRNA22を用いるのか、別のマイクロRNAを用いるのかは分かりませんが(がんによって老化に導くマイクロRNAは違うそうな。田原先生のグループでは老化誘導型マイクロRNAを多数同定しています)、細胞の老化に関わるマイクロRNAがあるのは間違いなさそう。
今までのようながん細胞も正常細胞も一緒に叩く抗がん剤は副作用も大きかったですが、元々体内に備わっているマイクロRNAを使えば副作用も抑えられます。
また、再発をしたがんは、抗がん剤への耐性が付いているため、既存の抗がん剤が使えない問題がありました。
その点老化誘導を促すマイクロRNAを使った治療法の場合、この抗がん剤耐性の問題も克服できる可能性があります。
一方、マイクロRNAは身体の中での安定性がとっても低いので、患部まで届けられないという問題も。
これを解決する手段が3DマトリックスさんのDDS(薬物を患部に届ける仕組み)「a6k」なのだ!
マトちゃんのDDSが本物であってほしいなぁ……
会社も期待しているDDS製品なんですが「製薬会社にサンプル供与はしてる」っていうのみで、現在のところお金を払ってでも使いたいって製品なのかは不明確です。
とりあえずは、がんセンターと共同で治験中のトリプルネガティブ乳がんを対象とする核酸医薬品「TDM-812」の結果が出なければ評価は難しいなぁと思っていました。
ただ、今回の田原先生は以前自らマイクロRNA用のDDS開発を行っておられた方です。
【参考:体液循環miRNA輸送機構を用いたがん特異的新規DDSの開発】
自分で開発をして有望な可能性が示唆されたDDSではなく、マトちゃんのDDSを採用したってことは案外評価が高いんだなぁと思ったり。
また上記の共同研究者はがんセンターの落合先生になっています。
落合先生はTDM-812のがんセンター側の責任者であり、RPN2siRNAの開発者です。
現在、TDM-812は治験中ではありますが、 a6kが落合先生からDDSとして一定の評価を得ていなければ、田原先生も採用しなかっただろうことは想像できるわけです。
もちろん、広島大学と3Dマトリックスの研究開発費の負担ってどうなってるのか分かりませんので(マトちゃんがお金をたくさん出すからa6kを使ってよって売り込んだ可能性もあるので)、正式な評価はやはり製薬企業との提携や導出が決まらないとできないと思います。
素人には結局のところ下世話な話ですが契約金の額でしか製品の価値を測れないんですが……ちょっとは期待しているぞ。
20兆円を超える世界の巨大DDS市場。
とりあず0.01%ゲットを目指してくれ。
それでも20億だぞーーー!
あ、あと決算説明資料にも記載がありましたが、脳腫瘍を対象とした核酸医薬品の研究も進めているよう。
脳には血液脳関門っていうバリア機能があるので、簡単に薬効が届かない。
マトちゃんのDDSが血液脳関門を突破できたらスゴイことになりそうだ。
「だからまだ基礎~前臨床の段階じゃねーか!!」って言われたらぐうの音も出ないけど……。
そもそもマトちゃんのDDSは局所投与にしか使えないものなのかもしれないしね(血管に注射したり、口から飲んだりして脳にまわすものじゃなくて、直接患部に投与するもの)。
まとめ
まだまだ非臨床試験のPOCを取るぞ!って段階ですので、本当に創薬の初期段階のお話。
株価が反応しないのも無理はないかと。
ただDDSはあらゆる核酸医薬品に適応可能なので、突然ポンとメガファーマと提携なんて話は……マトちゃんのことだから出てこないだろうなぁ( ノД`)
期待せずに待っています。
頑張れよマトちゃん。
どうせニーサ分30枚は数年売らないんだ。
それではみなさん、熱中症対策には十分気を付けて!










yukiyukiさん、こんばんは。
3DMのDDSについての解説、とてもわかりやすくて有難いです。
DDSはお金になるのか?、なるとすればいつ頃か?、とすぐに金勘定に気を取られますが、3DMの領域が広がるだけでも、株主としてはうれしいものです。
実は今日、私の80代の母親の手術があり、朝から病院で待機していましたが、無事に終わりました。
執刀医の先生は、御茶の子さいさいという感じで、摘出部位の説明をしてくれました。
医学の世界は日進月歩ですね。