いつもお世話になっております!
ぼくが愛するトンボ製薬ことデルタフライファーマさんが、肺がん治療薬14323の協和化学との提携解消を発表しました。
提携解消はバイオにとって、基本的には大きなネガティブインパクト。
翌日は大きくマイナスで始まりましたが、その後は反発して、現在は発表前比ちょい下げくらいになっています。
今日はこの14323について整理しておきます。
デルタフライの14323について訊いてみた。
提携解消は解消で悪材料なわけですが、起こったことはどうしようもないとして、ぼくが気になったのが、白血病治療薬ウベニメクスの後発品と14323との関係性。
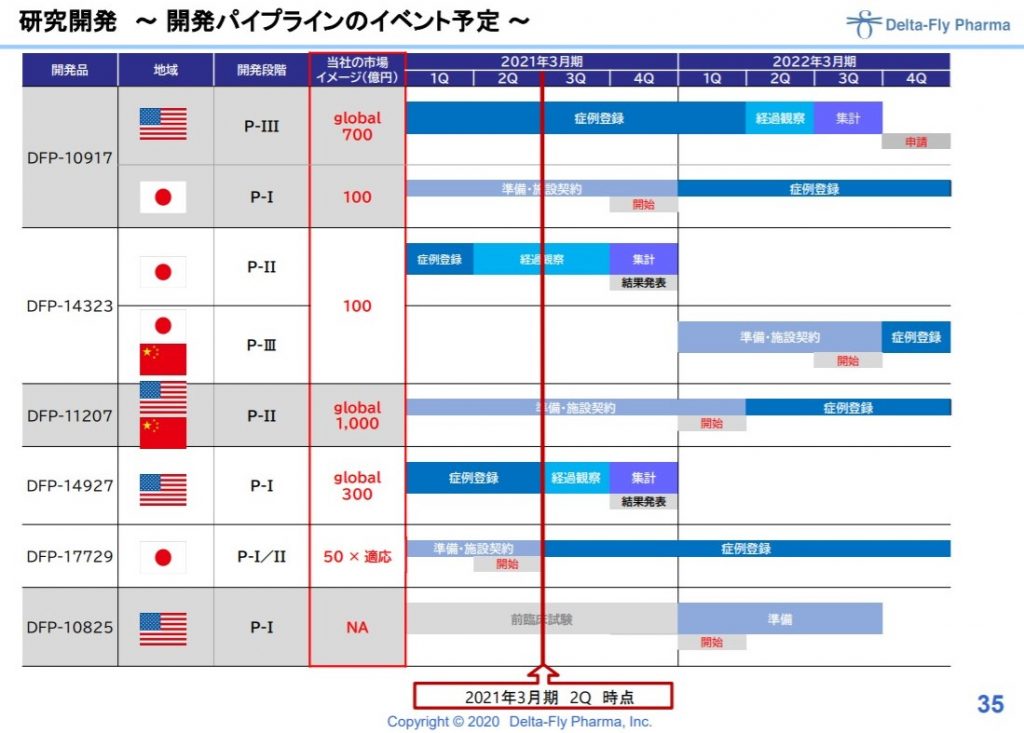
出典:デルタフライのお知らせ
すんげ―分かりにくく、あんまり注目されてないですが(今日、日経バイオには出てみたいですが)、今回はじめてウベニメクスの「効能拡大品」の製造販売承認申請を行うと記載が。
これが去年から全然分かんなかったんですよ。
2019年8月30日、デルタフライは「協和化学がウベニメクスの後発品の承認申請を行った」とのIRを発表しました。
このときぼくは、「協和化学が白血病適応のウベニメクスのジェネリック申請を行ったところで、デルタの14323はウベニメクスを改良して肺がんへの適応を目指すもの。当然、肺がんへの治験は別途必要であり、承認されたところで一ミリもデルタには関係ないだろ」と思っていました。
それが、提携解除のIRによって、期せずしてウベニメクスと14323の開発の流れが判明。
これを念のためIRさんに確認してみました。
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/05/cropped-logo.jpg” name=”(僕)” type=”l line”]これって、協和さんが申請していたウベニメクスの後発品については、御社が単独で承認を取りにいって、さらに来年には後発品として肺がんにも使えるように適応拡大の申請を行うという理解でいいんでしょうか?[/voice]
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/06/face14.gif” name=”(IRさん)” type=”r”]はい、その通りでございます[/voice]
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/05/cropped-logo.jpg” name=”(僕)” type=”l line”]さらにそれと並行して、ウベニメクスの投与量とかを変えたものを14323としてフェイズ3をやって、新薬として承認申請を目指していくというこういう流れになるということですか?[/voice]
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/06/face14.gif” name=”(IRさん)” type=”r”]はい、その通りでございます[/voice]
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/05/cropped-logo.jpg” name=”(僕)” type=”l line”]なるほどなるほど。そうすると、去年8月に協和さんが後発品の承認申請をされていますけど、通常1年くらいで承認されると思うんですが、これがまだ承認されていないというのは何か理由があるんでしょうか[/voice]
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/06/face14.gif” name=”(IRさん)” type=”r”]ええ、後発品の場合は多くが1年くらいで承認になるケースが多いんですが、あのー色々と後発品と言っても検査を受けたりですね、色んな当局からの問い合わせに対応したりだとか、色んなことがあって、対応が順調に言った場合は1年なんですけども、だいたい半年置きくらいにそれが伸びたりすることもあって、今回はまだすぐということではなくて、今のところは順調にいけば12月くらいになるんではないかという見方をしているんですけども。まだ当局から査察の話とか、その辺の話が来ていないので、まだどうなるかというと流動的なところがございます[/voice]
12月って言ったら来月じゃん。
ただバイオの「順調にいけば」はあんまりあてにならないので、ここは参考程度に。
何らかの検査があるようで、それ待ちの模様。
念のため再確認。
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/05/cropped-logo.jpg” name=”(僕)” type=”l line”]なるほどですね。とりあえず承認申請そのものが認められないような大きなリスクはないと?[/voice]
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/06/face14.gif” name=”(IRさん)” type=”r”]はい、通常ですと受け付けられた場合は、後発品ですと特別大きな問題がない限りは、あのー今までの事例ですと承認ということになっていますので、今回、わたくしどもが出した書類について、特段のそういう指摘を今の段階では受けておりませんので[/voice]
ここは一安心。
コロナの影響もあるので、今のところは大きな問題があっての遅延ではない印象。
あと一番聞きたいところ。
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/05/cropped-logo.jpg” name=”(僕)” type=”l line”]分かりました。これ後発品としてのウベニメクスであったり、肺がん適用のウベニメクスであったり、承認された際は販売はしていくんですか?[/voice]
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/06/face14.gif” name=”(IRさん)” type=”r”]はい、今のところ販売としての形をわたくしどもの会社、持っていないところもあるので、はい。今は販売を委託できるような会社さんとの提携とか、販売委託とか、そういう形を含めてどうしようかと準備をしているところです[/voice]
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/05/cropped-logo.jpg” name=”(僕)” type=”l line”]そうすると、3相を進めていくこととは別に後発品の販売委託先ももしかしたら[/voice]
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/06/face14.gif” name=”(IRさん)” type=”r”]はい、今のところは色々とそちらの方も検討しているというところです[/voice]
ただ、そこはこれまで数多くのバイオ悪女の「検討中」という言葉に裏切られているぼくですよ。
おバカなふりをして、実際におバカではありますが、さらに追い質問。
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/05/cropped-logo.jpg” name=”(僕)” type=”l line”]じゃあ販売するかどうかも今のところは決まってないというか[/voice]
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/06/face14.gif” name=”(IRさん)” type=”r”]えっと、一応、後発品の場合は承認を受けた場合にはですね、販売をするということが前提になっていますので、それに関してはどういう形にしろですね、わたくしどもが直接ということなのか、または委託なのか、他との提携なのか、色んな選択肢をもって準備を進めようと思っております[/voice]
あ、そうなの。
販売は前提なんだ。
ってことは新薬じゃないとしても、まずは後発品としての製品売上が立ってくるんじゃん。
え、キミたちこれ知ってました?
知ってたら教えてくださいよ。
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/05/cropped-logo.jpg” name=”(僕)” type=”l line”]今のところ販売形態が決まっていないので、承認された場合の業績へのインパクト的には不透明ですよね[/voice]
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/06/face14.gif” name=”(IRさん)” type=”r”]そうですね、今期についてはすぐ販売というわけではありませんので、当然影響はないと思っているんですが、次の期ですとか将来にわたってのところは、今のところ、販売に対して、販売できればもちろん少しわたくしども利益として得られますし、今度はどのくらい売れるかによっても利益がどうなのかというところもありますので、それについては今後計画も含めてご提示できるような形で、皆様にお伝えできればというふうには思っております[/voice]
あー聞いといてよかったわー。完全に勘違いしてた。
14323の前に、後発品ウベニメクスの承認なり、販売提携なりがあるかもです。
まあどれだけの売上に繋がるかは分かりませんが、バイオにとっては「ワンチャン思惑」は必要なので、これは良い初耳情報でした。
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/05/cropped-logo.jpg” name=”(僕)” type=”l line”]ちなみに来年申請の肺がん適用の後発品については、当然新薬ではないので、保護期間みたいなものはないんですよね?[/voice]
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/06/face14.gif” name=”(IRさん)” type=”r”]えーっと、通常は後発品については保護期間というのはなくて、特許の中でどこまでできるかというところですね。そういう意味では早く承認されればされるほど、特許期間は長く活かせることになります[/voice]
[voice icon=”https://yukiyuki13.net/wp-content/uploads/2017/05/cropped-logo.jpg” name=”(僕)” type=”l line”]分かりました! どうもありがとうございました[/voice]
まとめ
ということで、後発品と新薬とが入り混じっているので整理すると。
・ウベニメクスの既存の適応領域での後発品の承認がまずきます
・その後に後発品の肺がん適用の拡大申請を行います
・それと並行してウベニメクスに改良(これをモジュール創薬というかどうかはさておき)を施した14323を、新薬として承認ゲットするべく3相に突入する計画です
・併せて後発品については自社なのか、委託なのかはさておき、販売していく計画です
とまあこんな感じ。
後発品の承認や14323の3相直前に協和が手を引いた理由は分かりませんが(会社は当然認めないでしょうが、2相の結果が協和的にはイマイチだったという可能性はあると思っています)、カタリスト的にはかなり増えますね。
下には入っていない後発品絡みの材料があるかもです。
出典:デルタフライ決算説明資料
もちろんオンコリスとかデルタフライは煽りが多くて、イ〇ゴさんもたくさんいる印象なので、悪材料が出れば下にもぶっ飛ぶ可能性もあることには引き続き留意。
ぼくは増資1発はすでに覚悟しつつ、中長期で応援していきます。
それでは今日はこの辺で。
*特定の銘柄の売りも買いも推奨するものではありません。記載内容は100%事実とも限りません。投資は自己責任・自己判断でお願いします。








私は71歳の若造(ハート)です。いつも誠実で楽しい文書を拝見して感激しております。
先ずもって感謝・・・ありがとう。
さて最近はGNI情報がなくて淋しいのです。どうしたのでしょうか ? 拝